GRADO 10 - QUÍMICA
UNIDADES SUB ATÓMICAS Y EVOLUCIÓN DEL ÁTOMO
Buenas tardes:Cordial saludo, realizar la lectura correspondiente de la evolución del átomo, elaborar un mapa conceptual, realizar los dibujos y tomar una foto, hacerla en el cuaderno, analizar las partículas subatomicas y argumentar el significado.. Realizar la actividades el 20 de abril 2020.,
Enviar al correo glogoos@hotmail.es,
NOTA: Por favor en el Asunto del e-mail escribir: Grado - Nombre del Alumno - Asignatura.
Enviar y Adjuntar únicamente archivos en Microsoft Word. NO ajuntar a ningún tipo de Drive.
Gracias.
MODELO ATOMICO DE BOHR Y CONFIGURACION DE ELECTRONES
1. Profundizar el átomo de Bohr. analizar el modelo atómico de Bohr.
2. Identificar los niveles de energía.
3. Interpretar la ecuación cuántica.
4.Realizar el dibujo del esquema de Aufbau.
5.Elaborar un ensayo, del texto del modelo atómico de Bohr y la ilustración con todos los niveles de energía, nivel K al nivel Q
5. Analizar el principio de Pauli.
Enviar el 22 de Mayo. al correo glogoos@hotmail.es con los datos completos, nombre, apellido, grado al que pertenece, ejemplo ( 10-1, 10_2, 10-3,10_4) y asignatura. Por favor no utilizar apodos.Muchas gracias, espero se sigan cuidando.
Nota importante: Enviar los archivos una sola vez. Esperar a la revisión de los trabajos. Gracias.
CONFIGURACION DE ELECTRONES
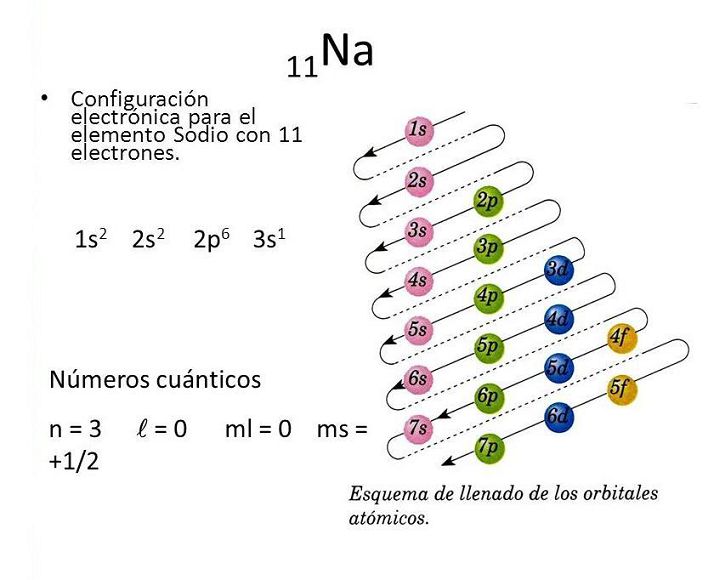
CONFIGURACIÓN DE ELECTRONES, NIVELES DE ENERGÍA Y SUBNIVELES DE ENERGÍA

El orbital S, son orbitales esféricos, los primeros 4 elementos de la tala periódica:: H, He, Li, y Be poseen nubes de carga esférica, y se representan con el orbital S.. Orbital P, no son esféricos presentan formas de lóbulos.. Presentan 3 orbitales de igual energía, pero de diferente orientación: orbitales Px - Py- Pz-
Observar las imágenes.



GIRO DEL ELECTRON O SPIN


El SPIN significa el giro que da el electrón, como pueden observar se representar con flechas una va hacia arriba y equivale +1/2 y -1/2 que va hacia abajo.. En cualquier orbital solo pueden caber 2 electrones..
DIAGRAMA DE ORBITALES



Y SE ESCRIBELa flecha que esta dirigida hacia arriba , significa que el SPIN es +1/2 y la que esta dirigida hacia abajo es -1/2. Para realizar el diagrama de orbitales, se busca el numero atómico del elemento, en la tabla periódica, el símbolo del numero atómico es : Z. Ejemplo, numero atomico del atomo de hidrógeno es: Z=1
Ejercicios; Representar los siguientes elementos en diagrama de orbitales y configuración. de electrones hidrogeno H , Helio He, litio Li , Berilio Be,
Estudiar para la evaluación final el 25 de Junio 2020
ELECTRONEGATIVIDAD
Cali, julio 3 2020
Se define como la capacidad de ceder y atraer electrones, tiene la función de clasificar los enlaces químicos, A. Enlace Ionico, Enlace Covalente Polar. C. Enlace Metálico
ISOTOPOS
Son átomos del mismo elemento, con el mismo numero atómico,que presentan diferentes masas atómicas. Ejemplo: El átomo del carbono tiene numero atómico Z=6 los isotopos son Carbono de masa 12 se representa con la letra C A=12 C A=13 C=14
Realizar 2 ejemplos de Isotopos
ELECTRONEGATIVIDAD
- La Electronegatividad está asociada a la Afinidad Electrónica y a la Energía de Ionización por lo que aumentará hacia la derecha y hacia arriba en la Tabla Periódica
- El elemento más Electronegativo es el Flúor
- El elemento menos Electronegativo es el Francio
- Los átomos de electronegatividades muy diferentes tienen tendencia a formar un enlace iónico
- Tipos de Enlace según la diferencia de Electronegatividad:
-
- Enlaces Iónicos: se producen cuando la diferencia de electronegatividades es mayor de 1,8, por ejemplo:
-
- NaCl → Na:0,9, Cl: 3,2 (diferencia de electronegatividades: 2,3)
- KBr → K: 0,8, Br: 3,0 (diferencia: 2,2)
- MgO → Mg: 1,3, O: 3,4 (diferencia: 2,1)
- Enlaces Covalentes Polares: se producen cuando la diferencia de electronegatividades está entre 0,6 y 1,7, por ejemplo:
-
- H2O → O: 3,4, H: 2,2 (diferencia: 1,2)
- NH3 → N: 3, H: 2,2 (diferencia: 0,8)
- Enlaces Covalentes no polares: se producen cuando la diferencia de electronegatividades es pequeña (menor de 0,6), por ejempl:
-
- CH4 → C: 2,6, H: 2,2 (diferencia: 0,4)
- La Electronegatividad afecta a la polaridad de las moléculas de manera que la carga negativa se concentra en el átomo más electronegativo. Esta es la razón de que por ejemplo los hidrocarburos sen poco polares (el Carbono y el Hidrógeno tienen electronegatividades muy parecidas), mientras que por el contrario el agua sea polar (el Hidrógeno y el Oxígeno tienen electronegatividades bastante diferentes).

Observen la gráfica de la recta numérica, los números enteros positivos van a la derecha, y los números enteros negativos van a la izquierda.
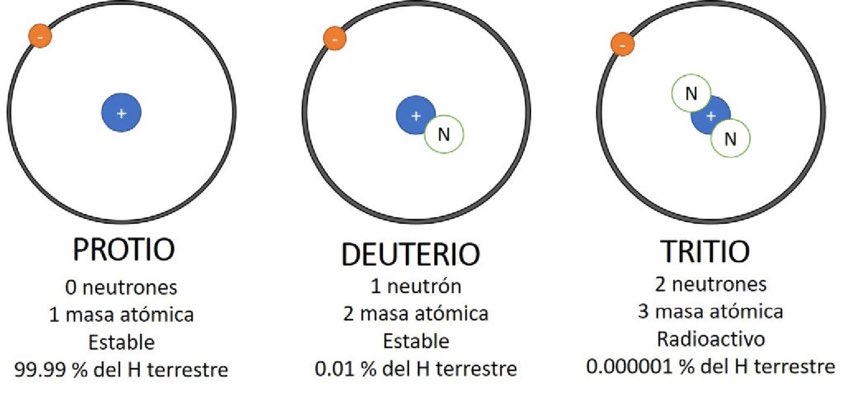
EJEMPLOS DE ISOTOPOS
- Protio Z=1 y A=1 (0 neutrones)
- Deuterio Z=1 y A=2 (1 neutrón)
- Tritio Z=1 y A=3 (2 neutrones) TENEMOS LOS ISOTOPOS DEL ÁTOMO DE HIDRÓGENO
ISOBAROS
- Calcio 40 - Argón 40.
- Carbono 14 - Nitrógeno 14.
- Carbono 12 - Boro 12.
- Cobalto 60 - Neodimio 60.
- Oxigeno 17 - Nitrógeno 17. Los isobaros, son aquellos elementos diferentes con la misma masa atómica
- ACTIVIDADES; Copiar la clase en el cuaderno de química, dibujar la recta numérica.
- -Investigar 2 ejemplos de enlaces ionices, covalentes polares y no polares,
CLASES DE MEZCLAS Y SEPARACION
Cali, Julio 10 2020

a palabra “mezcla” se utiliza para hacer alusión a la combinación de al menos dos sustancias diferentes, sin que exista una reacción química entre ellas. Pese a ello, cada una de las sustancias mantiene sus propiedades químicas, es decir, que no existen cambios químicos en absoluto.
Se pueden identificar dos tipos de mezclas: homogéneas y heterogéneas:
-
 Mezclas heterogéneas: Son aquellas en
las que puede distinguirse, a simple vista, las sustancias que componen la mezcla (Ej. aceite y
agua). Es por ello que se dice que no son uniformes. ya que las sustancias no se combinan. Lo mismo ocurre con una ensalada de, por ejemplo, lechuga y tomate.
Mezclas heterogéneas: Son aquellas en
las que puede distinguirse, a simple vista, las sustancias que componen la mezcla (Ej. aceite y
agua). Es por ello que se dice que no son uniformes. ya que las sustancias no se combinan. Lo mismo ocurre con una ensalada de, por ejemplo, lechuga y tomate.
-
 Mezclas homogéneas: En cambio, se caracterizan por ser uniformes. Presentan una sola fase.
Mezclas homogéneas: En cambio, se caracterizan por ser uniformes. Presentan una sola fase.
Ejemplos de Mezclas Homogeneas
| Azúcar en agua | Hidrógeno en Platino |
| Agua con sal (salmuera) | Mercurio en plata |
| Aire | Plata en Oro |
| Vino | Kerosene en agua |
| Té | Cera y agua |
| Bronce | Vinagre y Aceite |
| Oro 18 kilates | Sal y pimienta |
| Suelo | Granito |
| Oxígeno en agua | Detergente en agua |
| Alcohol en agua | Aceite en agua |
-Realizar 4 dibujos de mezclas homogéneas y heterogéneas
-Investigar las mezclas heterogéneas con los ejemplos. Dibujarlas en el cuaderno de química
NOTA: VAN TRABAJANDO AVISO FECHAS DE ENTREGA LOS TRABAJOS DE JULIO.. SOLO ENVIAN LO DE JUNIO Y YO YA LES ENVIE LAS FECHAS, NOMBRE COMPLETO, GRADO . POR FAVOR NO SE CAMBIEN LOS APELLIDOS. SI ALGUN ESTUDIANTE PRESENTA DIFICULTADES, DEBEN INFORMAR. CUIDENSE. GRACIAS
Cali, Agosto 14 2020
Muy buenos días, espero que se encuentren bien, cuidándose mucho
CLASES DE SEPARACIONES DE MEZCLAS
Las mezclas se pueden separar por diferentes métodos, dependiendo de sus componentes, mediante técnicas y procedimientos.
1. Tamizado 2. Decantacion, Filtración, Centrifugacion, Destilación, Cristalización, Evaporación Cromotografía.
ACTIVIDAD: Investigar cada una de las separaciones de mezclas, y dibujar .
Realizar el siguiente experimento:
Agua + Sal Agua + Azúcar Agua + fresco royal Harina + Agua Cafe + Agua si tienen colador pueden colar en química seria filtrar, o cafetera y utilizan papel filtro, Agua + Aceite. Mezclar muy bien y dejar reposar realizan las observaciones, las registran en el cuaderno le colocan la clase de mezcla y la clase de separación de mezcla, si no tienen alguna de las sustancias realizan las que puedan. Evaporación la podemos observar cuando hacemos el arroz esa sirve. Si desean cambiar las sustancias lo pueden hacer pero me pueden preguntar. si es viable o no. Los datos los escriben en una tabla de datos.
NOTA. Hasta este tema, ustedes envían los trabajos nombre claro, grado, asignatura y si alguno tiene dificultades . por favor informar. Gracias. Fecha , Agosto 19 2020
CARACTERISTICAS DE LA TABLA PERIODICA
a tabla actual consta de 18 grupos. Reciben este nombre por agrupar elementos de propiedades químicas similares. Las filas de la tabla se llaman periodos. ... Dentro de cada uno de ellos, los elementos están ordenados por número atómico creciente de izquierda a derecha.
A las columnas verticales de la tabla periódica se les conoce como grupos. Hay 18 COLUMNAS en la tabla periódica estándar, de los cuales diez son grupos cortos y los ocho restantes largos, que muchos de estos grupos correspondan a conocidas familias de elementos químicos.
LOS GRUPOS se escriben en numeros Romanos IA Metales alcalinos, II A Alcalinotereos III A elemntos del Boro IVA elementos del carbono, VA elementos del Nitrógeno, VI A elementos del oxigeno, VIIA Halogenos, VIIIA Gases nobles o gases inertes. Se clasifican en A y los del grupo B se les llama de TRANSICION . por que sus electrones de valencia no son estables.
La tabla periódica fue inventada en 1869 por el científico ruso Dmitri Mendeléyev quien trabajaba en la Universidad de San Petersburgo. Este químico creó una tabla para clasificar y distribuir los elementos químicos de acuerdo a sus propiedades y particularidades.
s
Los metales alcalinos son generalmente brillantes, blandos, maleables y fácilmente cortables, ligeros y altamente reactivos. Los alcalinos además son buenos conductores de la electricidad y del calor, son maleables y dúctiles.
Los metales son los elementos químicos capaces de conducir la electricidad y el calor, que exhiben un brillo característico y que, con la excepción del mercurio, resultan sólidos a temperatura normal. El concepto se utiliza para nombrar a elementos puros o a aleaciones con características metálicas.
ACTIVIDAD: NO envían el tema de hoy, igual como los otros temas, les doy la fecha, pero lo pueden ir trabajando, dibujar la tabla periódica el esquema sin símbolos solo con la división.
Cali, Agosto 21 - 2020
Muy buenos y bendecido día, espero que se encuentren muy bien, cuidándose , la clase de hoy es continuación del tema , voy a colocar unas actividades sencilla para enviar en la fecha indicada.
CONTINUACIÓN DE CARACTERÍSTICAS DE LA TABLA PERIÓDICA.
Colocamos los nombres a los grupos y a los periodos: IA METALES ALCALINOS, IIA ALCALINOTERREOS, IIIA ELEMENTOS DEL BORO, IVA ELEMENTOS DEL CARBONO, VA ELEMENETOS DEL NITROGENO, VI ELEMENTOS DEL OXIGENO, VIIA HALOGENOS, VIII GASES NOBLES O INERTES. LOS PERIODOS VAN EN FORMA HORIZONTAL SE ESCRIBEN CON NUMEROS ARABIGOS 1, 2,3,4,5,6,7
I AUMENTA LA ELECTRONEGATIVIDAD

La tabla presenta en la parte inferior 2 divisiones el numero 6 se llaman lantanidos, y el numero 7 se llama actinidos.son elementos radiactivos..
La tabla se divide en bloques IA - IIA CORRESPONDE AL BLOQUE S, IIIA AL VIIIA CORRESPONDE AL BLOQUE P LOS ELEMENTOS DE TRANSICIÓN QUE SE REPRESENTAN CON LA LETRA B CORRESPONDEN AL BLOQUE D Y LOS 2 DE LA PARTE INFERIOR CORRESPONDEN AL BLOQUE F
El elemento de mayor radio atómico es el Francio y el de menor radio stomico es el fluor.
El elemento de mayor electronegativo es el fluor y el de menor electronegatividad es el fluor.
ACTIVIDAD:
A. Colorear los bloques en la tabla periódica
B. Señala con flechas la electronegatividad y radio atómico, según las indicaciones en clase
C.Ubica en la tabla periodica el elemento de mayor radio atómico del periodo 4 y el elemento de menor electronegatividad del periodo 7
D. Investigar 5 propiedades de los metales y no metales
E. Buscar en la casa etiquetas de sustancias que utilicen en el hogar. Ejemplo límpido, investigar si son sustancias toxicas (dañinas) y sus componentes.. mínimo 3
F. Escribir los siguientes elementos en la tabla periódica, según el grupo y el periodo: CARBONO, HIDRÓGENO, BORO, NITRÓGENO, OXIGENO, LITIO , FLUOR, SODIO, BERILIO , PLOMO, URANIO, CLORO Y EL LAURENCIO.
FECHA DE ENTREGA 23 DE AGOSTO, NOMBRE CLARO, GRADO ASIGNATURA, HORA TODO EL DIA.
EL ESTUDIANTE CON DIFICULTADES DE CONECTIVIDAD, POR FAVOR INFORMAR CON OTRO COMPAÑERO DE CLASE. MUCHAS GRACIAS
Cali, Agosto 28- 2020
Muy buenos días , deseándoles que se encuentren muy bien y cuidándose.
La teoría del octeto, enunciada en 19161 por el fisicoquímico Gilbert Newton Lewis, dice que los iones de los elementos del sistema periódico tienen la tendencia a completar sus últimos niveles de energía con una cantidad de 8 electrones, de tal forma que adquieren una configuración muy estable. Esta configuración es semejante a la de un gas noble,2 los elementos ubicados al extremo derecho de la tabla periódica. Los gases nobles son elementos electroquímicamente estables, ya que cumplen con la estructura de Lewis, son inertes, es decir que es muy difícil que reaccionen con algún otro elemento. Esta conclusión es conocida como la regla del octeto.3
Estos son ejemplos de enlaces covalentes polares.

Los átomos de electronegatividades muy diferentes tienen tendencia a formar un enlace iónico. ... Enlaces Iónicos: se producen cuando la diferencia de electronegatividades es mayor de 1,8, por ejemplo: NaCl → Na:0,9, Cl: 3,2 (diferencia de electronegatividades: 2,3) KBr → K: 0,8, Br: 3,0 (diferencia: 2,2)31 ago. 2015
Lo podemos definir también cuando un elemento muy electropositivo, cede sus electrones de valencia a los mas electronegativos. para completar su ultima capa externa con los 8 electrones de valencia.
Ejemplo : el Na esta en el grupo IA tiene un solo electron por estar en el grupo I y lo sede al Fluor que se encuentra en el grupo VIIA y por estar en el VIIA tiene 7 electrones de valencia y cediendo el sodio su unico electron + los 7 del fluor = 8 cumpliendo asi la ley del octeto.
En el video lo pueden observa.
Enlaces covalentes polares y no polares , los covalentes polares son aquellos que comparten electrones de valencia . los apolares no comparten electrones de valencia.
Enlaces metalicos son aquellos que no comparten ni ceden electrones son un mar de cargas tanto positivas como negativas..Ejemplo la corriente electrica.
- xido de magnesio (MgO)
-
 Sulfato de cobre (CuSO4)
Sulfato de cobre (CuSO4)
-
 Ioduro de potasio (KI)
Ioduro de potasio (KI)
-
 Hidróxido de zinc (Zn(OH)2)
Hidróxido de zinc (Zn(OH)2)
-
 Cloruro de sodio (NaCl)
Cloruro de sodio (NaCl)
-
 Nitrato de plata (AgNO3)
Nitrato de plata (AgNO3)
-
 Fluoruro de litio (LiF)
Fluoruro de litio (LiF)
-
 Cloruro de magnesio (MgCl2)
Cloruro de magnesio (MgCl2)
-
 Hidróxido de potasio (KOH)
Hidróxido de potasio (KOH)
-
 Nitrato de calcio (Ca(NO3)2)
Nitrato de calcio (Ca(NO3)2)
-
 Fosfato de calcio (Ca3(PO4)2)
Fosfato de calcio (Ca3(PO4)2)
Fuente: https://www.ejemplos.co/20-ejemplos-de-enlace-ionico/#ixzz6WNk5uGCA
Actividades: Copiar la clase de hoy y observar los vídeos de enlaces químicos copiar los ejemplos.
https://www.youtube.com/watch?v=dWh4wf5VgMs
Nota_ estos vídeos son únicamente para utilizarlos como educativos. gracias
Observar el video No.1 No2 . realizar un resumen de cada uno y lo clasifica , entregar el 2 de septiembre.
CALI, SEPTIEMBRE 18 2020
Buenos Dias
Espero que se encuentren bien y auto cuidándose la clase del día de hoy se las voy a presentar por la aplicación google meet, para los que no pudieron entrar a la plataforma y los que asistieron a la clase virtual, observar y analizar las diapositivas y realizar los ejercicios con la estructura de lewis de las siguientes moléculas:
-Agua
-Metano
-Amoniaco
Enviar los 3 ejercicios al correo.
Cali, Septiembre 24- 2020
Muy buenos días, ¡Buena suerte!
La semana del 5 al 9 fue de Desarrollo Institucional del SEM
Cali, Octubre 16 2020
Muy buenos días, espero se encuentren muy bien, hoy les voy a dictar la clase por meet google. si tienen el correo Institucional lo pueden utilizar.
a las 10:05 inicio con 10-3 y 10-4 a las 11:10 Inicio con 10-1 y 10-2
Muchas gracias. Si alguno de los estudiantes tienen problemas de conectividad por favor informar.
Luego cargo las diapositivas. de la clase de hoy
Realizar los 4 ejercicios, estas son las diapositivas de la clase de hoy.
Cali, Octubre 23- 2020
Buenos días, espero que se encuentren bien.
Los 4 ejercicios anteriores no lo han enviado, Solo unos pocos estudiantes.
Realizar el siguiente ejercicio en clase:
. Investigar la formula del acido fosfórico y buscar la masa.
COMPOSICION PORCENTUAL
La Composición Porcentual de un elemento en una molécula se calcula a partir del peso molecular y viene determinada por la siguiente fórmula:
|
Composición Porcentual =
|
MASA MOLECULAR DEL ELEMENTO EN EL COMPUESTO |
· X 100 %
|
| MASA MOLECULAR DEL COMPUESTO. |
Ejemplos de Composición Porcentual:
Ejemplo 1: Calcular la composición porcentual del H y O en el agua (H2O) si la masa molecular del agua es 18 y los pesos atómicos del H y del O son 1 y 16 respectivamente:
H 2 = 2 X 1 = 2
O = 1 X 16 = 16/ 18 g
Se multiplica la cantidad de átomos por la masa molecular de cada átomo. En el ejemplo anterior la masa molecular del agua , H20
es 18 g
|
% H =
|
2g H |
x·100 %
= 11,11% de Hidrógeno
|
| 18 g H20 |
|
% O =
|
16g O · |
x·100% = 88,88% de
Oxígeno
|
|
18g H2O
|
Se suman los porcentajes . H 11.11% + O 88, 88 % = 99,99% por aproximación da 100%
Ejemplo 2: Calcular la composición porcentual del H, S y O en el ácido sulfúrico (H2SO4) si su peso molecular es 98 y los pesos atómicos del H, S y del O son 1, 32 y 16 respectivamente:
Calculo la masa molecular de cada uno de los átomos del compuesto así:
H2 = 2 x 1 = 2
S = 1 X 32 = 32
O4 = 4 X 16 = 64/ 98 g la suma de las masas moleculares del compuesto es de 98g
|
% H2 =
|
2 g H |
x 100% = 2, 04
|
| 98g H2SO4 |
|
% S =
|
32 gS |
X 100% =
32,65%
|
| 98g H2SO4 |
|
%O =
|
64g O |
x 100% = 65,3% de
Oxígeno
|
|
98 g H2SO4 |
Sumamos los porcentajes o resultados : H2 2,04% + S 32g % + 65,3 % = 99% por aproximación da como resultado 100%
Se trabaja con 2 decimales
ACTIVIDAD EN CLASE:
Calcular la composición porcentual del etano (CH3-CH3) respectivamente. Enviar al correo
Cali, Octubre 30 - 2020
Muy buenos y bendecido día
Voy a resolver e ejercicio:
Tenemos la formula del etano, separa cada uno de los átomos para encontrar l a masa asi:
C = 12 X1 = 12
H3 = 1 X 3 = 3
C= 12 X 1= 12
H3 = 1 X3 = 3/30 g
Observen que desglose la formula completa con cada uno de sus átomos lo multiplique, para encontrar la masa del compuesto.
Terminen el ejercidos: según los ejemplos anteriores.
Algunos estudiantes solo sumaron el CH3 no es la formula completa y no multiplicaron por la cantidad de átomos
ACTIVIDAD;
CALCULAR LA COMPOSICION PORCENTUAL DEL DIOXIDO DE ASUFRE: SO2 ENVIAR A CORREO EN EL LAPSO DE TIEMPO ASIGNADO EN EL HORARIO 2 HORAS DE CLASE DE QIMICA
FORMULAS EMPIRICAS
En química la fórmula empírica es una expresión que representa la proporción más simple en la que están presentes los átomos que forman un compuesto químico. Es por tanto la representación más sencilla de un compuesto.1 Por ello, a veces, se le llama fórmula mínima
Para hallar la fórmula empírica de un compuesto,2 primero se obtienen los moles de cada elemento, luego se divide cada uno por el de menor valor y finalmente, por simplificación, se hallan los números enteros más sencillos posibles.
EJEMPLO;
Al llevar a un análisis al laboratorio de 86 , 4 g de Pb con 13,6 g de S CALCULAR LA FORMULA EMPIRICA.
Busco la masa molecular de cada átomo asi:
H = 1
POR QUE LOS 86,4 g de átomos de S los voy a pasar a moles
1. FACTOR DE CONVERSION EN FORMA DE FRACCIONARIOS.
Pb = 86,4, 4 g Pb / 1 X 1 mol Pb / 207 g Pb
S = 13,6 g S/ 1 x 1 mol de S/ 32g S
En el factor de conversión se iguala a la unidad matemáticamente es 1
2. PASO: CONVERTIR A MOLES , ESCOJO EL FRACCIONARIO DONDE DICE MOL
Pb = 86,4g Pb/1 x 1 mol Pb / 207 g Pbg = O,41 MOLES CANCELAMOS LOS GRAMOS
1 MOL DE S 13,6 g S/1 X X 1 MOL S/32gS = O,42 MOLES S
3. Se divide el numero de moles de cada elemento, entre el valor mas pequeños, asi;
Pb = O,41 MOLES/ O,41 MOLES = 1
S = O,42 MOLES/ O,41 MOLES = 1,02
La relación de moles es; 1:1 la formula empírica es : PbS nombre químico sulfuro de plomo.
Ejemplo:
Se encontró que una muestra de un hidrocarburo tiene 85,71 g Carbono (C) y 14,29 g de hidrogeno (H) Determina la formula empírica.
Nota : SE LES RECUERDA EL ENVIO DE LOS TRABAJOS DE LOS PERIODOS PENDIENTES.
POR FAVOR NO ENVIAR LOS TRABAJOS DEL CUARTO PERIODO NO ACUMULADOS Y ESTO LO DEBEN DE REALIZAR ANTES DE LAS REUNIONES DE COMITE DE PROMOCION Y EVALUACION.
LOS ESTUDINTES QUE HAN ENVIADO RECUPERACIONES DE PERIODO ANTERIORES , DEBEN HACER EL FAVOR DE ESPERAR QUE ZETI ESTE ABIERTA.
HOY SOLO ENVIAN COMPOSICION PORCENTUAL Y EN EL TIEMPO ASIGNADO.
Cali, Noviembre 6 - 2020
Muy buenos días:
Espero que tod@s se encuentren bien, auto cuidándose.
Como pueden ustedes analizar, el cuarto periodo es mas corto. Los estudiantes que deben logros del 1°, 2° y 3° deben estar enviando. Los temas del 4° periodo igualmente.
La plataforma Zeti esta abierta para ingresar las notas.
No dejen acumular estos trabajos, algunos estudiantes de los diferentes 10° están enviando actividades.
ACTIVIDAD DE REFUERZO
1. Hallar la masa atómica de los siguientes compuesto y investigar su uso a nivel Industrial.(Pueden investigar en el internet)
A. NaOH (Hidróxido de sodio)
B. CH4 (Gas metano)
Pasar a moles los siguiente:
A. Un alambre de cobre Cu tiene de masa 26g
B. Un globo con 64 g de oxigeno 0
3. Determinar la formula empírica del siguiente compuesto:
GLUCOSA: 40g de C, 6,72 g H , 53,3 g O
4.Determinar el % en masa de FeS (sulfuro de hierro)
La anterior actividad es de retroalimentación. No copiar los ejercicios que aparecen en el Internet, realizarlos según las explicaciones.
Recuerden que las masa de los elementos se encuentran en la tabla periódica
Realizarlas en el cuaderno
TIEMPO . 10 AM - 12PM (2 horas de clase)
Estudiantes con dificultades de Internet, comunicar. Gracias






